Begrepene «anode» og «katode» er fundamentale i studiet av elektrokjemi og elektroniske kretser. Disse to elektrodene spiller avgjørende roller i en rekke systemer, fra alminnelige batterier til avansert teknologi.
La oss utforske de distinkte forskjellene, deres positive og negative benevnelser, og hvordan man enkelt kan identifisere hvilken elektrode som er negativ og positiv.
Hva er en elektrode?
Før man går dypere inn i forståelsen av hva en katode eller anode er, er det viktig å forstå det grunnleggende konseptet av hva en elektrode egentlig er. I sin enkleste form er en elektrode et materiale som muliggjør ledning av elektrisitet, slik at elektrisk strøm kan passere inn i eller ut av et ikke-metallisk stoff, som for eksempel en elektrolysecelle.
En elektrode fungerer med andre ord som en leder som skaper elektrisk kontakt med en ikke-metallisk del i en krets.
Hva er en anode?

Polariteten til en elektrode, om det er en anode eller katode, er avhengig av kretsens type. Anoden er den elektroden hvor oksidasjonsprosessen finner sted, noe som innebærer et tap av elektroner. I en galvanisk celle (som omvandler kjemisk energi til elektrisk, som et batteri under utladning), fungerer anoden som den negative elektroden. Dette skjer fordi under oksidasjon blir elektroner igjen på elektroden og deretter flyter gjennom den eksterne kretsen.
I motsetning til dette, i elektrolyse, der en elektrisk strøm forårsaker elektronbevegelse i motsatt retning, blir anoden den positive elektroden.
Hva er en katode?
 Bildekreditt: Raspberry Pi
Bildekreditt: Raspberry Pi
Katoden er stedet der reduksjon skjer, og det muliggjør at elektroner mottas. I en galvanisk celle fungerer den som den positive elektroden, da ioner gjennomgår reduksjon ved å motta elektroner fra elektroden, og deretter avsettes de.
I elektrolyse, derimot, er katoden den negative terminalen, som tiltrekker seg positive ioner fra løsningen.
Anode vs. katode: Forklaring av polaritet
Tidligere trodde man at elektrisitet fløt fra positiv til negativ, motsatt av det vi i dag vet er korrekt. Denne feilaktige antakelsen har ledet noen til å assosiere anoden med negativitet og katoden med positivitet.
Men med en klar forståelse av rollene til oksidasjon og reduksjon i hver elektrode, blir det enkelt å identifisere hvilken som er anoden og katoden. Dette er imidlertid avhengig av kretsens type.
Hva er en elektrolytt i et batteri?
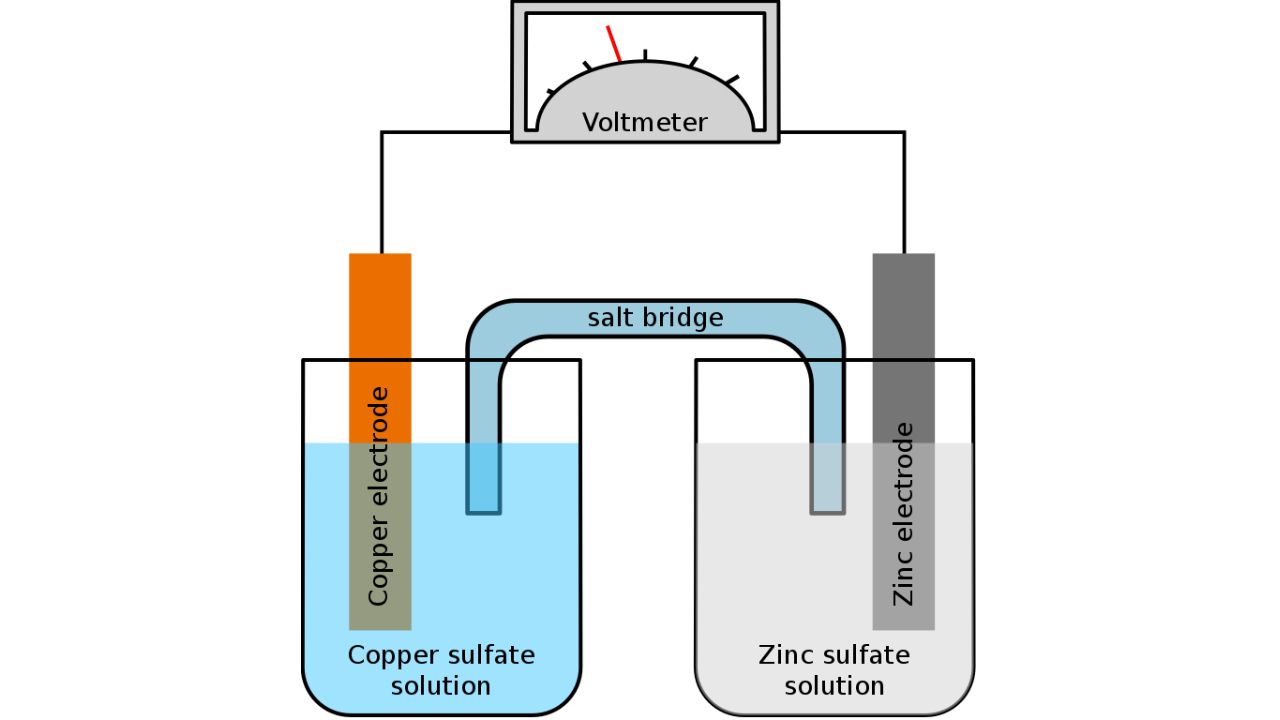 Bildekreditt: Tinux/gringer/Wikimedia Commons
Bildekreditt: Tinux/gringer/Wikimedia Commons
I batterier refererer elektrolytten til mediet som tillater bevegelse av ioner mellom anoden og katoden, samtidig som de holdes elektrisk nøytrale. Denne ioniske bevegelsen er avgjørende for de kjemiske reaksjonene som skjer under lade- og utladningsprosessene. For ytterligere informasjon, les om hvordan litium-ion batterier for elbiler fungerer.
Hvilken er positiv?
For å forstå polariteten når man diskuterer elektroder i en celle eller krets, er det essensielt å se på de to reaksjonene som foregår på de to stedene. I en galvanisk celle gjennomgår anoden oksidasjon og fungerer som den negative elektroden, mens den i elektrolyse blir den positive. Katoden, derimot, fremmer reduksjon og fungerer som den positive elektroden i en galvanisk celle, men den fungerer som den negative terminalen i elektrolyse.